Данные, приведенные в предыдущих девяти статьях библиотеки (1, 2, 3, 4, 5, 6, 7, 8, 9), и на рисунках 1-10 данной статьи, позволяют установить следующие закономерности в изменении значений средних энтальпий разрыва химических связей, образуемых переходными (Еп) и непереходными (Енп) элементами в их органических соединениях:
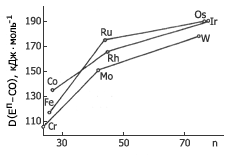
Рис. 1. Изменение средней энтальпии разрыва связи Еп-СО
с ростом атомного номера элемента
1. В соединениях EпLn переходных элементов одной и той же группы, с одинаковым лигандом (L) при одинаковом п величина D(Eп–L) увеличивается с ростом атомного номера элемента вдоль группы.
Для переходных элементов первого ряда эта величина значительно меньше, чем для переходных элементов второго ряда, тогда как для переходных элементов второго и третьего рядов она имеет, как правило, близкие значения (рис.1-4).
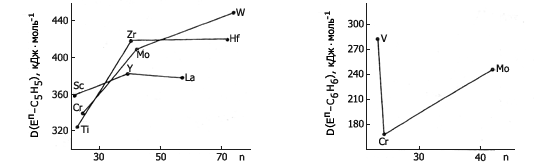
Рис. 2. Изменение средней энтальпии Рис. 3. Изменение средней энтальпии
разрыва связи Еп-С5Н5 с ростом разрыва связи Еп-С6Н6 с ростом
атомного номера элемента атомного номера элемента
2. Для одного и того же переходного элемента во всех случаях
D(Eп–OR) > D(Eп–C5H5) > D(Eп–С6Н5) > D(Eп–СО).
3. Влияние алкильных заместителей в бензольном лиганде бисареновых соединений хрома на величину D(Cr–L) находится в пределах ошибки ее экспериментального определения.
4. В ряду V, Cr, Mn, Fe величина D(Еп–С5Н5) в соединениях Еп(С5Н5)2 зависит от атомного номера элемента качественно так же, как энтальпия атомизации соответствующего элемента (рис.5).
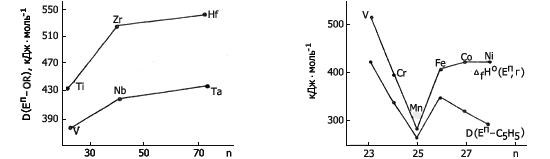
Рис. 4. Изменение средней энтальпии Рис. 5. Зависимость энтальпии
разрыва связи Еп-OR с ростом атомизации элементов и средней
атомного номера элемента энтальпии разрыва связей Eп–C5H5
 от атомного номера элемента вдоль от атомного номера элемента вдоль
 3d-ряда периодической системы 3d-ряда периодической системы
Однако, несмотря на близкие значения энтальпий атомизации Fe, Со и Ni (соответственно, 417, 428 и 429 кДж·моль-1), энтальпия разрыва связи Fe-C5H5 на 27 кДж·моль-1 превышает D(Co–С5Н5), которая в свою очередь на 25 кДж·моль-1 больше, чем D(Ni–C5H5). Это согласуется с квантово-химическими представлениями, согласно которым на разрыхляющей орбитали кобальтоцена имеется один электрон, а на разрыхляющих орбиталях никелоцена – два электрона.
Корреляция между величинами D(Еп–С5Н5) и энтальпией атомизации соответствующих элементов наблюдается также в ряду трициклопентадиенильных соединений редкоземельных элементов La, Pr, Тm и Yb, для которых ΔfH°(Еп, г) составляет соответственно 431, 373, 247 и 152 кДж·моль-1.
Корреляция между величинами D в карбонильных соединениях переходных элементов и соответствующими значениями ΔfH°(Еп, г) рассмотрена в литературе, откуда следует, что для всех изученных карбонилов наблюдаются соотношения:
D(Еп–СО) ≈ (0,28 ± 0,04)·ΔfH°(Еп,г)]
и
D(Еп–Еп) ≈ 2/nΔfH°(Еп, г)],
где п – координационное число в соответствующих кристаллических веществах.
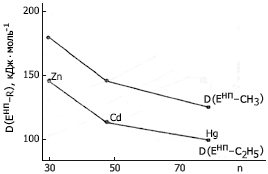
Рис. 6. Изменение средней энтальпии разрыва
связей Енп–R, образуемых элементами II группы
в соединениях EнпR2, с ростом атомного
номера элемента
5. В соединениях EнпRn непереходных элементов одной и той же группы периодической системы, с одинаковым радикалом (R) при одинаковой величине n энтальпия разрыва связи Eнп–R уменьшается с ростом атомного номера элемента Енп вдоль группы (рис.6-10).
6. Во всех случаях для одного и того же непереходного элемента
D(Eнп–C6H5) > D(Енп–С2Н3) > D{Енп–СН3) > D(Енп–С2Н5) ≈
≈ D(Енп–n-С3Н7) ≈ D(Енп–n-С4Н9).
7. Средняя энтальпия разрыва связи Eнп-n-R на 4-17 кДж·моль-1 превышает D(Eнп–i-R).
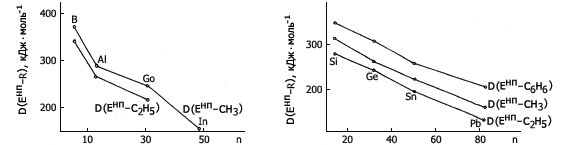
Рис. 7. Изменение средней энтальпии Рис. 8. Изменение средней энтальпии
разрыва связей Енп–R, образуемых разрыва связей Енп–R, образуемых
элементами III группы в соединениях элементами IV группы в соединениях
EнпR3, с ростом атомного номера EнпR4, с ростом атомного номера
элемента элемента элемента
8. Средние энтальпии разрыва связей Eнп–OR в (RO)nEнп, где R – алкильный радикал, для одного и того же Енп, но разных R, в пределах 4 кДж·моль-1 совпадают между собой и примерно на 60 кДж·моль-1 превышают соответствующие значения D(Eнп–OC6H5).
Обращают на себя внимание более высокие значения энтальпий разрыва связей Енп–О, образуемых кремнием и германием в соединениях (R3Eнп)2O, по сравнению с соответствующими значениями тех же величин в (RO)4Eнп.
9. В литературе предложено вычислять средние энтальпии разрыва связей Е–СО для процессов, когда Е и СО остаются в тех же валентных состояниях, в которых они предполагаются в исходной молекуле. Эта величина получила название средней «внутренней» энтальпии разрыва связи (Di).
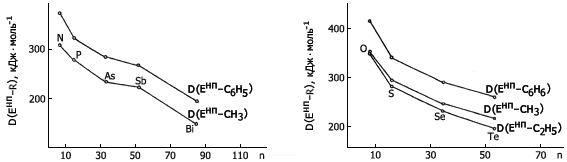
Рис. 9. Изменение средней энтальпии Рис. 10. Изменение средней энтальпии
разрыва связей Енп–R, образуемых разрыва связей Енп–R, образуемых
элементами V группы в соединениях элементами VI группы в соединениях
EнпR3, с ростом атомного номера EнпR2, с ростом атомного номера
элемента элемента элемента
Очевидно, что Di(E–CO) = D(Е–СО) + ΔНЕ + ΔНCO, где ΔНЕ – энтальпия возбуждения элемента Е в его валентное состояние, ΔНCO – энтальпия перехода СО в валентное состояние.
С использованием метода ССП МО ЛКАО, вычислены значения ΔНЕ и ΔНCO для соответствующих связей в карбонильных соединениях 3d-элементов. Результаты этих расчетов, а также найденные с их учетом величины Di(Dп–СО) приведены ниже (кДж·моль-1).
| Соединение |
D(Eп–CO) |
ΔHE |
ΔHCO |
Di(Eп–CO) |
| Cr(СO)6 |
107 |
160 |
94 |
361 |
| Mn2(СO)10 |
99 |
167 |
95 |
361 |
| Fe(СO)5 |
118 |
177 |
80 |
375 |
| Co2(СO)8 |
136 |
169 |
61 |
366 |
| Ni(СO)4 |
147 |
165 |
49 |
361 |
Как видно из приведенных данных, величины Di(Еп–СО) имеют близкие значения – усредненное значение их составляет 365 ± 10 кДж·моль-1. Постоянство Di(Е–СО) в рассмотренных соединениях согласуется с соответствующими квантово-химическими расчетами.
Аналогичным путем установлено приблизительное постоянство величин Di(En–CO) для карбонильных соединений элементов 4d-ряда (Di ≡ 415 кДж·моль-1) и 5d-ряда (Di ≡ 460 кДж·моль-1). Близкие значения величин Di(Еп–L) характерны также для дициклопентадиенильных и бис-бензольных комплексов переходных элементов.
В расчетах Di(Eп–L) использованы найденные из атомных спектров значения энтальпий возбуждения атомов Еп в валентное состояние. Энтальпии реорганизации бензола и циклопентадиенильного радикала в состояния, в которых они находятся в соответствующих молекулах, неизвестны, однако есть основания считать, что как в ряду дициклопентадиенильных, так и в ряду бис-бензольных соединений они имеют близкие значения. Это, в частности, подтверждается близкими значениями энтальпий сублимации обсуждаемых веществ.
Полученные величины Di(Eп–L) без учета энергии перестройки лигандов L приведены ниже. Расчеты проведены по уравнению
Di(Еп–L) = D(Еп–L) + 1/2 ΔНE,
где ΔНE – энтальпия перехода атома Еп из стандартного состояния в состояние dn.
| Соединение |
D(Eп–L) |
ΔHE |
Di(Eп–L) |
| (С5H5)2V |
423 ± 12 |
243 |
545 |
| (С5H5)2Cr |
339 ± 10 |
423 |
550 |
| (С5H5)2Mn |
268 ± 10 |
540 |
538 |
| (С5H5)2Fe |
352 ± 11 |
397 |
550 |
| (С6H6)2V |
284 ± 6 |
243 |
405 |
| (С6H6)2Cr |
168 ± 3 |
423 |
380 |
| (С6H6)2Mo |
247 ± 6 |
305 |
399 |
Из данной таблицы следует, что среднее значение Di(Еп–С5Н5) составляет 546 ± 8, а усредненная величина Di(Eп–C6H6) равна 395 ± 15 кДж·моль-1.
Как следует из приведенного выше экспериментального материала, с ростом атомного номера элемента вдоль групп периодической системы величины Di(Eнп–R) с одинаковым радикалом изменяются в том же направлении, что и соответствующие величины ΔfH°(Енп, г), а величины D(Eп–R) и D(Eп–L) с одинаковым радикалом или лигандом изменяются в том же направлении, что и соответствующие величины ΔfH°(Еп, г).
В связи с этой закономерностью следует обратить внимание на то, что энтальпия образования атомарных непереходных элементов с ростом их атомного номера вдоль группы периодической системы уменьшается, а та же величина переходных элементов в том же направлении, наоборот, увеличивается. Основной причиной этого является противоположное влияние на межатомное взаимодействие следующих двух факторов: 1) увеличения заряда атомного ядра с ростом атомного номера, что во всех случаях усиливает межатомное взаимодействие, и 2) изменения атомного радиуса элементов вдоль групп периодической системы. В подгруппах непереходных элементов атомный радиус сверху вниз по подгруппе сравнительно сильно увеличивается, что ослабляет межатомное взаимодействие как в самом элементе (в конденсированном состоянии), так и в образуемых им связях Е–R, и этот фактор преобладает над влиянием роста заряда ядра. В подгруппах же переходных элементов с ростом атомного номера вдоль группы атомный радиус их или слабо растет, или сначала слабо растет, а затем, наоборот, слабо уменьшается, так что преобладает влияние роста заряда ядра на энергию межатомного взаимодействия.
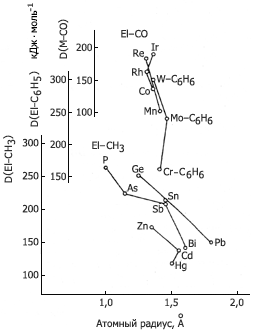
Зависимость средней энтальпии разрыва ряда
химических связей, образуемых элементами
в их органических соединениях, от атомного
радиуса элемента (радиусы – ван-дер-ваальсовы)
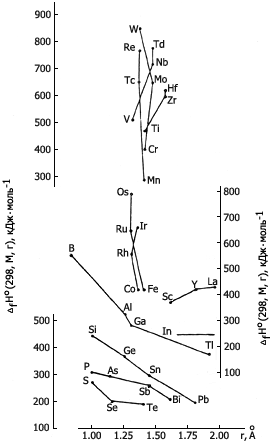
Зависимость энтальпии образования элементов
в газообразном (атомарном) состоянии
от их атомного радиуса
|