Для измерения энтальпии окиси бериллия был применен метод смешения с использованием кипящего калориметра. Тепло, вносимое образцом в калориметр, определяется по увеличению количества испарившейся жидкости за время главного периода по сравнению с соответствующей величиной во вспомогательных периодах. С целью тарировки установки были проведены измерения энтальпии, причем интервал исследования был расширен до 3200К. Полученные результаты хорошо совпали с наиболее надежными литературными данными.
Таблица 1
Энтальпия нагревания BeO
| T, K |
H(T)–H(298,15),
кал·моль-1 |
T, K |
H(T)–H(298,15),
кал·моль-1 |
| 2023 |
19646 |
2834 |
51590 |
| 2130 |
21452 |
284S |
52598 |
| 2223 |
22588 |
2867 |
52233 |
| 2266 |
22418 |
2891 |
53641 |
| 2378 |
24764 |
2898 |
52910 |
| 2533 |
27095 |
2928 |
53892 |
| 2537 |
26997 |
3031 |
55507 |
| 2708 |
29161 |
31591 |
58691 |
Экспериментальные результаты представлены в табл. 1. Погрешность данных в области высоких температур оценивается в 1–1,5%, причем значительная доля погрешности связана с тем, что при предельно высоких температурах (2800–3200К) приходится применять ампулы с толщиной стенок не менее I мм или даже двойные ампулы, что, естественно, ведет к уменьшению доли тепла, вносимого исследуемым веществом по отношению к энтальпии ампулы.
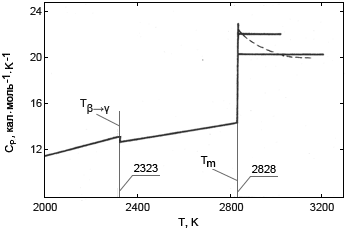
Рис. 1. Температурная зависимость теплоемкости BeO
Сравнение полученных результатов там, где имеются литературные данные (твердая фаза), обнаружило вполне удовлетворительное соответствие с наиболее надежными из них. Энтальпия твердой фазы аппроксимируется уравнениями (I) и (II). Анализ этих уравнений приводит к величине теплового эффекта структурного превращения в точке фазового равновесия (~2323К) ΔНβ→γ = 0,6 ккал·моль-1. Погрешность этой величины можно оценить в 30–35%
Н(Т)–Н(298,15) = 7656 + 0,467·T + 0,002742·T2 (I)
(гексагональная структура, 2000–2323К)
Н(Т)–Н(298,15) = 3867 + 4,760·T + 0,001712·T2 (II)
(кубическая структура, 2323–2828К)
Результаты по энтальпии жидкой окиси бериллия во всем исследованном интервале температур (до 3200К) обработаны в виде уравнения (III)
Н(Т)–Н(298,15) = -5639 + 20,306·T (III)
(жидкая фаза, 2828–3200К)
В целях получения более точных данных о теплоте плавления и теплоемкости жидкости около точки плавления была выполнена отдельная обработка результатов без учета наиболее высокотемпературных точек (уравнение IV).
Н(Т)–Н(298,15) = -10565 + 22,031·T (IV)
(жидкая фаза, 2828–2930К)
Расчет по уравнениям (II) и (IV) дает теплоту плавления ВеО ΔmH = 20,7 ккал·моль-1 с погрешностью около 5%. Как видно из уравнений (III) и (IV), теплоемкость жидкой фазы (рис. 1) уменьшается от значений около 22 ккал·моль-1 вблизи температуры плавления до ~20 кал·моль-1K-1 при Т > 3000К.
|