Калориметрическому определению энтальпий образования твердых растворов щелочных галогенидов посвящено довольно большое число работ. Однако, все эти работы выполнены для твердых растворов, не имеющих пробела смешиваемости и образованных компонентами с кристаллической структурой типа NaCl. Большинство теорий твердых растворов щелочных галогенидов позволяет рассчитывать энтальпию образованияд ΔH для твердого раствора также с кристаллической структурой типа NaCl. Исключение составляет теория Вазашерна, дающая возмокность рассчитывать энтальпии образования для твердых растворов с кристаллическими решетками как типа NaCl, так и типа CsCl.
В данной работе изучались энтальпии образования твердых растворов CsCl–RbCl и CsJ–CsBr, причем для последней системы проводился расчет ΔH по теории Вазашерна. Твердые растворы CsJ–CsBr имеют кристаллическую структуру типа CsCl и пробел смешиваемости от 11,1 до 82,3 мол.%. Твердые растворы образованы компонентами, кристаллизующимися как в решетке типа NaCl, так и CsCl, причем пробел смешиваемости находится в интервале от 10,7 до 93,3 мол.%.
Большинство ранее выполненных работ проводилось на дифференциальных калориметрах. Однако, для твердых растворов с большим пробелом смешиваемости применение такого метода измерения могло привести к значительным погрешностям из-за вероятных ошибок за счет несоответствия составов твердого раствора и механической смеси.
Энтальпии образования твердых растворов рассчитывались из экспериментальных значений энтальпий растворения твердого раствора и чистых компонентов. Измерение энтальпий растворения проводилось на адиабатическом калориметре с двумя адиабатическими оболочками. Данный калориметр обладал калориметрической чувствительностью примерно 0,001 кал, температурной чувствительностью примерно 5·10-5°, изменение температуры регистрировалось термисторами конструкции В. Г. Карманова. Значение ΔH рассчитывается как разность энтальпий растворения, величина которых на порядок больше величины энтальпии образования, поэтому погрешности в конечном значении ΔH находились в пределах 5–15%.
Твердые растворы и приготавливались путем быстрого охлаждения до комнатной температуры расплава смеси чистых солей заданного состава и последующего отжига (около 50 часов) при температуре на несколько десятков градусов ниже температуры плавления твердого раствора. Существование твердых растворов подтверждалось проведенным рентгеновским фазовым анализом.
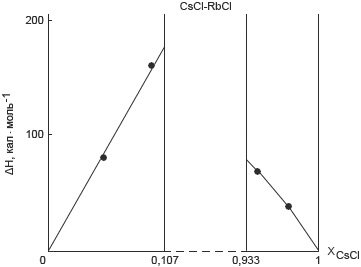
Рис. 1. Энтальпия образования твердого раствора CsCl–RbCl
(XCsCl – мольная доля CsCl в твердом растворе)
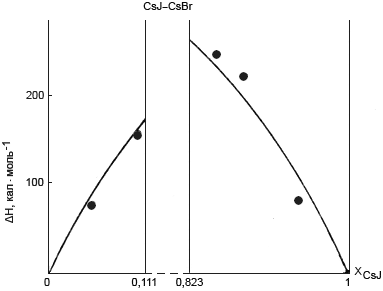
Рис. 1. Энтальпия образования твердого раствора CsJ–CsBr
(сплошная кривая – расчет по теории Вазашерна,
точки – экспериментальные данные)
Экспериментальные данные по энтальпиям образования исследованных твердых растворов приведены на рис. 1 и 2. На рис. 2 приведены также расчеты величины ΔH по теории Вазашерна по формуле:
ΔH = Q1{V1/8[1 + σ(1 – 4q)] + V2/8[1 + σ(1 – 4p)] + 1/2(1 + σ)}
где Q1 – вклад в величину Δ за счет электростатического потенциала, V1 и V2 – характеристические параметры чистых солей, p и q – молярные доли компонентов твердого раствора, σ – «степень местного порядка». Величины Q1, V1, V2 и σ рассчитываются из значений физических постоянных чистых солей – коэффициентов сжимаемости K, коэффициентов объемного термического расширения γ и постоянных решеток R. Для расчетов использовались следующие численные значения физических постоянных для CsJ и CsBr, соответственно: 4,2953Å и 4,5679Å, 6,83·10-12 и 8,6·10-12 см2/дин, 14,3·10-5 и 14,6·10-5 град-1.
Аналогичные расчеты для системы CsCl–RbCl могли быть проведены из-за различия в структуре исходных компонентов.
Как видно из рис. 1 и 2, величина ΔH закономерно изменяется с изменением состава твердого раствора, при этом экспериментальные данные в пределах ошибок опытов согласуются с результатами расчетов по теории Вазашерна.
|